El nuevo catalizador que podría ayudar a convertir el dióxido de carbono en otros combustibles de manera económica y eficiente.
Imaginémonos que todo el dióxido de carbono (CO2) generado por la combustión de los combustibles fósiles en las diversas máquinas que los necesitan para funcionar, desde un coche, pasando por un alto horno hasta una central térmica, se pudiera recoger de las chimeneas y transformarse de nuevo en combustible. Esto que parece una utopía, podría convertirse en realidad en un futuro cercano según los resultados de las investigaciones de los químicos Milad Ahmadi Khoshooei y Omar Farha, de la Universidad Northwestern (Evanston, Illinois, EEUU). En un artículo publicado recientemente en la prestigiosa revista Science informan del descubrimiento de un catalizador potencialmente barato y estable que puede convertir eficazmente el CO2 en monóxido de carbono (CO), compuesto que es la molécula de partida para la formación de multitud de otros compuestos más complejos como plásticos, diésel o los combustibles para aviones.
Con el aumento del calentamiento global de los últimos años y siendo, según la mayoría de los estudios, el CO2 el máximo responsable, investigadores de todo el mundo han fijado su mirada en este compuesto. Muchos abogan por la completa eliminación de los combustibles fósiles de tal manera que el CO2 asociado a su combustión no llegue ni a formarse (de esta manera se elimina el CO2 originado por la combustión de este tipo de combustibles, pero hay otras fuentes de CO2 como las erupciones volcánicas, la descomposición de la materia orgánica o los incendios forestales, luego el CO2 no va a dejar de formarse, aunque se eliminen estos combustibles). Otros colegas, más realistas, conscientes de que las emisiones no van a parar ni probablemente a reducirse a corto plazo, buscan soluciones para evitar que la mayor cantidad de CO2 llegue a la atmósfera. Una de las vías más estudiadas es la de tratar de atraparlo y almacenarlo de forma permanente de alguna manera sin que llegue a la atmósfera. Existen varias estrategias para hacer esto (quizás las expliquemos en una futura publicación), pero todas tienen complicaciones técnicas evidentes. Sin embargo, existe otro enfoque que se basa en descomponer el CO2 directamente tras su formación en otros compuestos de tal forma que no lleguemos a tener ni que preocuparnos por él.
La reacción de conversión del CO2 en CO es, sobre el papel, sencilla:
CO2 → CO + ½ O2
Se trataría “simplemente” de quitarle uno de los dos átomos de oxígeno al CO2 para quedarnos con una molécula de CO y un átomo suelto de oxígeno. Sin embargo, esta reacción requiere de un gran aporte de energía porque los enlaces del CO2 son muy estables. Normalmente, cuando hablamos de aportar más energía, queremos decir que tenemos que calentar más el sistema. Esto es así porque a mayor temperatura, mayor movilidad de las moléculas y átomos y mayor facilidad para romper los enlaces. Siguiendo esta premisa, las empresas están desarrollando reactores que suministran la energía necesaria para romper los enlaces del CO2 calentando el gas de CO2 a más de 1000 °C. Pero para generar esas temperaturas, normalmente necesitamos quemar combustibles fósiles (las energías renovables no son capaces, por lo general, de generar energía suficiente para calentar un reactor a 1000 °C), lo que genera una gran huella de carbono. De este modo, sí generamos CO para las aplicaciones que necesitamos, pero a la vez generamos más CO2.
Un catalizador es una sustancia que, en pequeña cantidad, incrementa la velocidad de una reacción química y se recupera sin cambios esenciales al final de la reacción. Es decir, que una reacción a la que se le añade el catalizador adecuado termina más rápido que la misma sin catalizador.
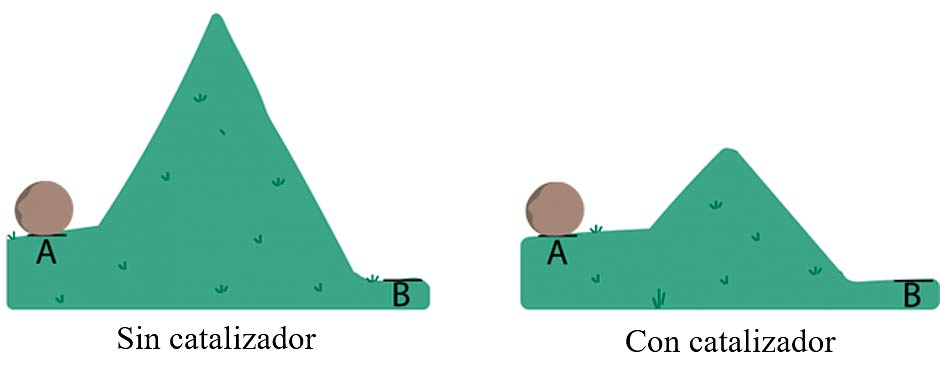
Sin embargo, existe una manera para reducir la temperatura de descomposición del CO2, y es con el uso de catalizadores. Un catalizador es una sustancia que, en pequeña cantidad, incrementa la velocidad de una reacción química y se recupera sin cambios esenciales al final de la reacción. Es decir, que una reacción a la que se le añade el catalizador adecuado termina más rápido que la misma sin catalizador. Esto ocurre así porque el catalizador proporciona un camino de reacción alternativa. En esta nueva ruta alternativa la velocidad de la reacción aumenta porque la energía de activación disminuye. La energía de activación es la energía mínima necesaria para que se produzca una reacción química dada. Esto queda bien ilustrado en la figura 1. Si queremos llevar la roca del punto A al B (transformar los reactantes A en los productos B) sin catalizador tenemos que elevarla por encima de una montaña mucho mayor que si utilizamos catalizador. Es decir, que tenemos que invertir mucho más esfuerzo (energía) para mover esa roca de A a B si no usamos catalizador.
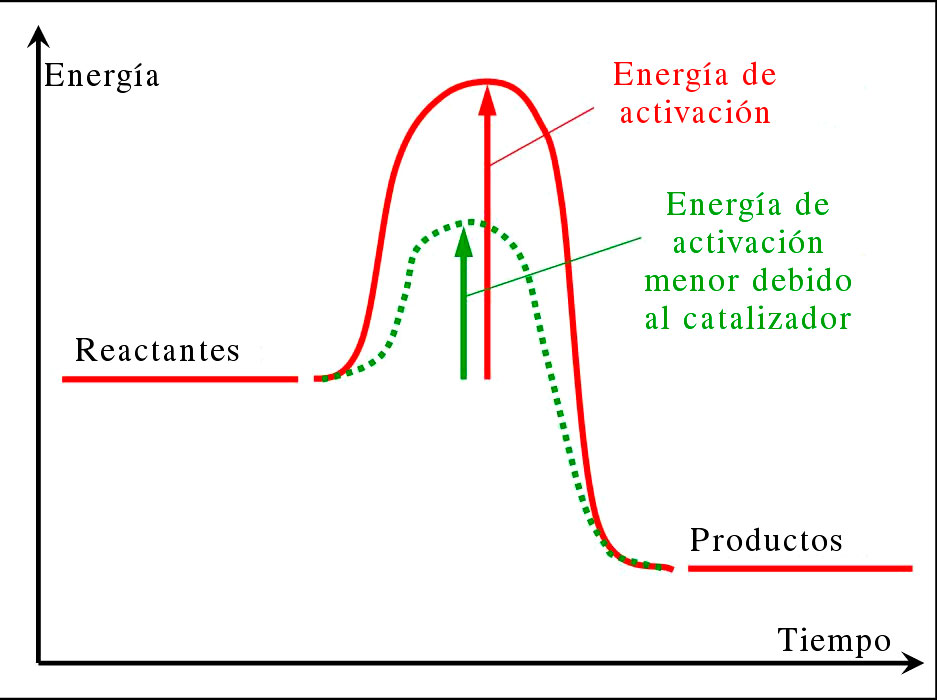
En la Figura 2 podemos ver este mismo efecto, pero usando ya términos de química: vemos que el camino desde los reactantes hasta los productos es “más suave” si usamos un catalizador.
El problema es que, los mejores catalizadores para estas reacciones de alta temperatura contienen metales preciosos muy caros, como el platino, y además pierden su eficacia rápidamente. Sin embargo, parece que el uso de un catalizador en particular podría ser una solución para realizar la conversión de CO2 en CO de una manera mucho más eficiente desde un punto de vista energético.
Se trata de una fase cristalina concreta del carburo de molibdeno (Mo2C según su fórmula química) denominada α-Mo2C. En los últimos años, los investigadores han estado investigando catalizadores económicos basados en molibdeno, pero todos tenían la desventaja de que se degradaban demasiado rápido o que no eran lo suficientemente selectivos: en lugar de producir CO puro, también generan metano, un componente químico menos útil. Sin embargo, este nuevo carburo de molibdeno no solo produce CO extremadamente puro a partir de CO2, sino que es muy estable. Este compuesto fue descubierto al realizar lo que se denomina “carburización” de un compuesto, en este caso, de un compuesto del molibdeno. Este proceso se basa en someter un determinado compuesto a un tratamiento térmico en presencia de carbono (C), de tal manera que átomos de este último se introduzcan en la matriz del compuesto que queremos “carburizar”. De esta forma obtenemos lo que se denominan carburos. Este es un proceso muy utilizado en la industria del acero, ya que es precisamente la presencia del carbono lo que hace transformar el hierro en acero (el acero es una mezcla de hierro con un porcentaje entre el 0.008% y 2.11% de la masa total de C). Como decíamos, en este caso se carburizó un compuesto de molibdeno (en concreto el (NH4)6Mo7O24·4H2O) mediante una reacción de éste con ¡azúcar común! a 500 °C durante dos días y en una atmósfera rica en hidrógeno gas (H2). Evidentemente, está claro que este proceso de fabricación abarata los costes porque evitamos el uso de metales preciosos para sustituirlos por molibdeno, que es un metal mucho más barato y más abundante que los metales preciosos, y simple azúcar.
El nuevo carburo de molibdeno no solo produce CO extremadamente puro a partir de CO2, sino que es muy estable. Este compuesto fue descubierto al realizar lo que se denomina “carburización” de un compuesto, en este caso, de un compuesto del molibdeno.
Pero este catalizador no solo permite abaratar costes, sino que ofrece un rendimiento mucho mejor que el resto. Este catalizador tiene una selectividad del 100%, lo que significa que no deja residuos indeseados en el CO que se obtiene. Para comprobar esto, el material se probó en condiciones reales en un pequeño reactor en la universidad donde se llevó a cabo la que se conoce como “Reverse Water-Gas Shift (RWGS) reaction” (Reacción inversa de cambio de agua-gas en español):
CO2 + H2 ⇄ CO + H2O
Como podemos ver, esta es una reacción reversible (una reacción reversible es aquella en la que los productos pueden volver a reaccionar para obtener los reactantes de nuevo, se indica con las dos flechas ⇄) en la que el CO2 reacciona con hidrógeno para dar CO y agua (H2O), todo en forma de gas. Esta es una reacción muy importante en la industria porque así se produce CO puro o, dependiendo de las condiciones y como la reacción es reversible, también el gas llamado “gas de síntesis” que es una mezcla de CO y H2 y que tiene multitud de usos como la producción de metanol, la obtención de hierro del mineral o el refinado del petróleo. De nuevo, esta reacción requiere del uso de un catalizador porque en condiciones normales es muy lenta. Y es con esta reacción con la que los investigadores se dieron cuenta de que la selectividad del CO era del 100 % pues los productos de reacción eran 100% CO y H2O sin ningún residuo indeseado como el metano que suele ser común en este tipo de reacciones.
Otro de los detalles interesantes de este catalizador es que, al trabajar a temperaturas más bajas, en torno a 600 °C, los reactores que lo contengan podrán ser alimentados con energía proveniente de fuentes renovables.
Además, el uso de este catalizador permite llevar a cabo la reacción a 600 °C, una temperatura mucho más baja que los 1000 °C a los que el CO2 se convierte en CO en condiciones normales o que la Reacción inversa de cambio de agua-gas. Y probablemente lo más importante, es extremadamente estable: un pequeño reactor de laboratorio funcionó de forma inalterada más de 500 horas, un hito espectacular para un compuesto recién descubierto.
Otro de los detalles interesantes de este catalizador es que, al trabajar a temperaturas más bajas, en torno a 600 °C, los reactores que lo contengan podrán ser alimentados con energía proveniente de fuentes renovables. Esto favorecería la creación de un mercado para las enormes cantidades de CO2 que las empresas planean capturar no solo de las chimeneas, sino también del océano y el aire. Incluso se podría pensar en crear una economía circular en la que los combustibles críticos para la sociedad se generen a partir del CO2 atmosférico, sin necesidad de quemar combustibles fósiles adicionales, lo cual, evidentemente, implicaría unas emisiones netas cero de CO2 a la atmósfera (figura 3).
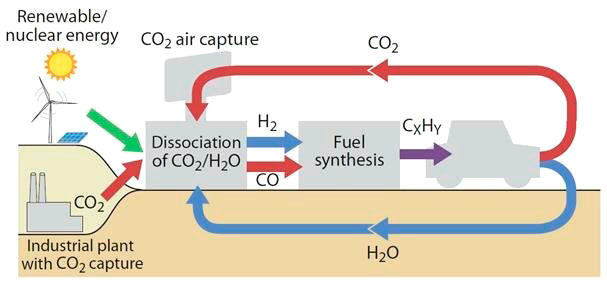





Interesante posibilidad, pero la energía nuclear no es cierto que tenga emisiones nulas. No puede seguir incluyéndose como solución, por todos los problemas que crea.